先発品企業が命運を託す「薬価維持特例」(3)―質疑応答
■ 「革新性と平均値は相反する概念」―対馬委員(支払側)
[対馬忠明委員(健康保険組合連合会専務理事)]
日薬連さんに1つはお願い、1つは質問。
 まず、お願い。「未承認薬等開発支援センター」、これ、前に話を聞いた時には、「大変難しいんだろうな」という感じがした。それが、会員各社、合意形成に大変ご尽力いただき、早くにつくっていただいた。大変、敬意を表したいと思う。
まず、お願い。「未承認薬等開発支援センター」、これ、前に話を聞いた時には、「大変難しいんだろうな」という感じがした。それが、会員各社、合意形成に大変ご尽力いただき、早くにつくっていただいた。大変、敬意を表したいと思う。
ただ、問題は「実効性が上がるか」ということだと思うので、ぜひ、実効が上がるようにご尽力を賜りたい。これがお願い。
それからもう1点。
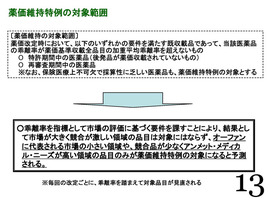
「薬価維持特例」、13ページ(薬価維持特例の対象範囲)、14ページ(予測される薬価維持特例の対象領域)について。
〔薬価維持の対象範囲〕「薬価維持特例」を中医協で議論してきたのは、基本的に「革新的な新薬」をベースに、念頭に置いて議論してきた。
薬価改定時において、以下のいずれかの要件を満たす既収載品であって、当該医薬品の乖離率が薬価基準収載全品目の加重平均乖離率を超えないもの
○ 特許期間中の医薬品(後発品が薬価収載されていないもの)
○ 再審査期間中の医薬品
※なお、保険医療上不可欠で採算性に乏しい医薬品も、薬価維持特例の対象とする
 それで、専門委員から説明があった時にも、「薬価維持特例」については、「加重平均乖離率」で見るんだと、こういうこと。
それで、専門委員から説明があった時にも、「薬価維持特例」については、「加重平均乖離率」で見るんだと、こういうこと。
ちょっと私も......、技術屋さんではない事務屋なので、よく分からないのは、「革新的」ということと、「平均値を取る」ということは、基本的には相反する概念ではないかと思う。
「革新的新薬、それは平均値でやります」というのが、どういうモノの考え方なのか、そこがよく分からないというのが1点目。
例えば、革新的な新薬というのは、これこれこうだと。「特許期間中の医薬品」と「再審査期間中の医薬品」と書いてある。
その中でも、「これとこれとこういうのは革新的だとみなしましょうや」と。ただし、それだけで概念規定するのは、ちょっと問題なので、やはり市場のチェックもかけましょうと。
で、市場のチェックとしては、平均でやりましょうというなら、まだ分かる。
それが、最初に「革新的」と言っておいて、すぐに「市場の平均値だ」と、ここがよく分からない。
特に、「採算性に乏しいものなんかも入れましょうね」と言った途端に、また一段とよく分からなくなる、というところが1つ。
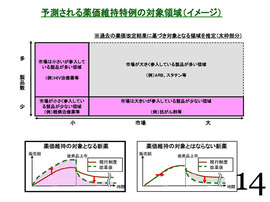 それと、今の話との関連だが、次の(14)ページに、具体的に少し姿が出ているが、これだけでは先程申し上げた「革新的新薬」というのが目的で、手段として「平均値的なものを使っていこう」ということだが、目的が手段によってきっちり確保されているのかどうか。
それと、今の話との関連だが、次の(14)ページに、具体的に少し姿が出ているが、これだけでは先程申し上げた「革新的新薬」というのが目的で、手段として「平均値的なものを使っていこう」ということだが、目的が手段によってきっちり確保されているのかどうか。
そこは、これを見ただけではよく分からない。
これから本格的な議論をするのであれば、もう少し具体的な姿が見えるような形で提示いただけると、もっと具体的な議論ができるが、「これだけではなかなか難しいな」というのが......。多少、感想も含めてだが、お願いします。
[遠藤部会長]
あの、ちょっと私からも補足すると、「未承認薬等開発支援センター」については、実効が重要であるということ。
 実際の進み具合については中医協で報告するとしているが、ただし、まだよく分かりにくいところがあると。
実際の進み具合については中医協で報告するとしているが、ただし、まだよく分かりにくいところがあると。
例えば、日本に法人がないような会社の薬を誰か引き受けてくれるか、一生懸命に探したと。努力はしたけれども、誰も引き受けてくれなかったという世界なのか、誰かが必ず引き受けるのか、そういうところが見えてこないので、そこを少しはっきりする必要があるというのが最初の質問だろう。
2つ目の質問は、確かに当初議論していた時に、対象となる医薬品というのは、「ある程度、革新性のあるもの」という議論がされた。
ところが、最終的に本日の話ではっきりしたのは、「革新性」とか、そういう概念は入れないと。
基本的に特許を取っていれば対象となる。ただし、乖離率が一定の水準以下ということは、事実上、競合が少ないということなので、その中にはたぶん革新性のものが含まれるだろうというような意味合いで、基準は基本的に特許を取っていることと、乖離率が小さいという、この2つの基準に統一したということなので、それが今までの議論と多少違う。
もっと言うならば、「革新性」ということと、「乖離率」との関係が本当にうまくマッチした議論になるのかどうか。そこら辺の議論。私も実は同じように感じているので、お答えできることがあればお願いしたい。
[庄田・日本製薬工業協会会長]
最初の「未承認薬等開発支援センター」の件は、(中医協に)ご報告するということ。日薬連の資料の別紙に付いている通り、現在、実際に開発に着手する企業がない成分が、3成分(システアミン、ベタイン、経口リン酸塩製剤)ある。
このように、現時点での未承認薬、このようなものが課題であると、こういう認識を持っている。先程、要望があった通り、こういうものをしっかりと開発を進める企業を求め、支援をしていく。このような心構えでいる。
2点目は、エフピアの陳述にもあった通り、「革新」という言葉を「イノベーション」という言葉に直すと、新薬の開発そのものが、私どもは革新であると思っている。
これまでの新薬の研究・開発の歴史の中で、例えば抗生物質で言えば、ペニシリンから始まって、セファロスポリン、マクロライド、その他の優れた新薬が創出されてきたが、最初に出たものはまず革新性がある。
ただし残念ながら、その企業にとっては、その革新性を、市場に出た後、他の企業が損なうということで、結果、市場においては、その革新性が市場で再評価されると革新性がないと。
従って、先程から何度か申し上げた通り、承認(薬価収載)時のみ革新性を求めるということではなく、やはり医療現場で実際に使っていただき、競争優位があると。その結果、平均乖離率以内であると。これが革新性の証であると、このような考えで、対象を設定している。
[関口・米国研究製薬工業協会(ファルマ)在日執行委員長]
(発言)よろしいでしょうか?
[遠藤部会長]
はい、どうぞ。
