がん医療を拓く① 融合遺伝子を探せ
 がんは、遺伝子に異常を起こした細胞が、無限に増え続ける病気です。遺伝子の異常は大抵いくつも重なっていますが、なかにはそれ1個の働きを妨害するだけで、がんが増え続けられなくなるという根幹の異常遺伝子もあると分かってきました。
がんは、遺伝子に異常を起こした細胞が、無限に増え続ける病気です。遺伝子の異常は大抵いくつも重なっていますが、なかにはそれ1個の働きを妨害するだけで、がんが増え続けられなくなるという根幹の異常遺伝子もあると分かってきました。
 可能性が高いものとして注目されているのが、細胞分裂の際に働く「キナーゼ」という種類の酵素を作る遺伝子が無秩序に活性化する異常です。次々と酵素を作り出して、細胞分裂が止まらなくなります。逆に遺伝子由来の酵素の働きを妨げると、分裂は止まります。
可能性が高いものとして注目されているのが、細胞分裂の際に働く「キナーゼ」という種類の酵素を作る遺伝子が無秩序に活性化する異常です。次々と酵素を作り出して、細胞分裂が止まらなくなります。逆に遺伝子由来の酵素の働きを妨げると、分裂は止まります。
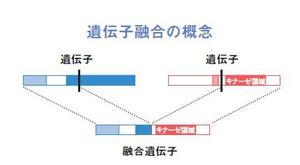
そして遺伝子融合という異常を起こした場合に、無秩序な活性化をすることが多いようなのです。
遺伝子融合とは文字通り、2種類の遺伝子がそれぞれ途中でちぎれて、入れ替わってつながってしまうことです。がん細胞にだけ見られるようなキナーゼ遺伝子の融合があった場合、がんの根幹原因となっている可能性は高いのです。
遺伝子発見が特効薬に直結
がんの根幹原因となるキナーゼの融合遺伝子の存在は、血液がんでは古くから知られていました。世界で競争が始まるきっかけとなったのは、07年に自治医科大学の間野博行教授のグループが、固形癌であり世界で年間137万人が亡くなる肺がんでも「EML4‐ALK」と呼ばれる融合遺伝子を発見したことでした。
覚えなくて構いませんが読み方は「イー・エム・エル・フォー・アルク」となります。ハイフンでつながれた前後それぞれが遺伝子の名前で、後ろ側のALK(アルク)がキナーゼを作る遺伝子です。
11年8月、その発見から僅か4年というかつてない早さで、ALK阻害剤(クリゾチニブ)が米国で承認販売され、既に目覚ましい治療効果が報告されています。
こうして、他にもがんの根幹原因となっている融合遺伝子はあるはずと、多くの臓器のがんについて、融合遺伝子の探索と、それを応用した診断・治療の研究が、世界中で進められることになりました。
日本が一歩リード
この融合遺伝子の探索と診断で世界をリードしているのが、公益財団法人がん研究会がん研究所の分子標的病理プロジェクトです。プロジェクトリーダーの竹内賢吾医師が血液病理医として培った知識、技術、経験を活かし、病理組織学を応用した探索システムを開発してきました(詳しくは次項で)。
これまでに肺がん、乳がん、卵巣がん、子宮がん、大腸がん、腎がんから、原因となっている融合遺伝子を計15種類も発見しています。
自治医科大学との共同プロジェクトで、肺がんから、キナーゼ領域がALKではなく、「ROS1」(ロスワン)や「RET」(レット)の融合遺伝子を計6種類見つけたことは、新聞などでも大きく報道されたように、世界的に注目されています。
 注目を集めるのは、キナーゼを作る融合遺伝子の発見は新薬開発に直結するからです。キナーゼそのものは既に多くの種類が確認され、その働きを妨げる薬(キナーゼ阻害剤)も数多く開発済みです。あとは、どのキナーゼ遺伝子の融合が、どのがんに存在するか分かれば、すぐ臨床試験(治験)へと移れるわけです。
注目を集めるのは、キナーゼを作る融合遺伝子の発見は新薬開発に直結するからです。キナーゼそのものは既に多くの種類が確認され、その働きを妨げる薬(キナーゼ阻害剤)も数多く開発済みです。あとは、どのキナーゼ遺伝子の融合が、どのがんに存在するか分かれば、すぐ臨床試験(治験)へと移れるわけです。
実際、甲状腺がんの治療薬として米国で承認済みのRET阻害剤(バンデタニブ)が、動物細胞レベルながら肺がんについても有効性を確認されています。
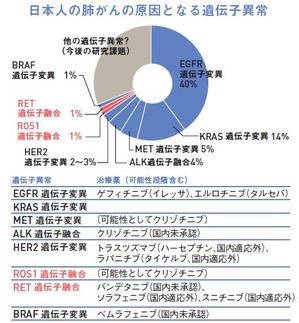
ちなみに実は、肺がん治療でもうお馴染みとも言える「イレッサ」(ゲフィチニブ)あるいは「タルセバ」(エルロチニブ)も、EGFRと呼ばれるキナーゼの一種を阻害する薬です。イレッサはEGFR遺伝子に変異がある場合に効果が高いことが分かっています。日本人の肺がん患者の4割程度に変異がある、つまり、4割の肺がん患者に効く、ということです。
一方、ALK融合遺伝子を原因とするのは肺がんの4%。EGFR遺伝子変異の割合と比べると正直、小さい数字に見えるかもしれません。しかし日本だけで年間7万人が亡くなっているわけですから、約3千人が該当します。該当すれば特効薬があるというのは、非常に大きなことです。
ROS1やRETの融合遺伝子を持つ肺がんは、両者合わせて2%程度と推測されています。「該当者には確実に効く」特効薬に直結する発見に間違いありません。
既に日本人の肺がんの5割以上は、原因となる遺伝子の異常(融合遺伝子やEGFR遺伝子変異など)が明らかになっています。将来的には、ほぼすべて突き止められ、原因ごとに特効薬も揃うかもしれません。
