がん医療を拓く② 新薬をふるい出せ
新薬はこうして見つかった
 ZSTK474がPI3キナーゼ阻害剤として開発されるに至った経緯は、ちょっと特殊でした。元々は全薬工業で作られた化合物で、マウスを使った実験ではがんの増殖を抑える効果が確認されたものの、どうして効くのか分からずにいました。つまり、がんのどこに作用する、どんな化合物なのか、見当もつかなかったのです。
ZSTK474がPI3キナーゼ阻害剤として開発されるに至った経緯は、ちょっと特殊でした。元々は全薬工業で作られた化合物で、マウスを使った実験ではがんの増殖を抑える効果が確認されたものの、どうして効くのか分からずにいました。つまり、がんのどこに作用する、どんな化合物なのか、見当もつかなかったのです。
そこで注目されたのが、がん研分子薬理部のスクリーニング手法です。
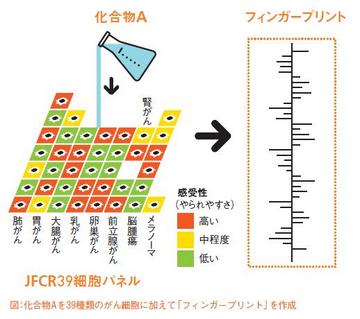
多数の化合物から抗がん剤になるものを探しあてるために、ふるいにかける作業を、スクリーニングと言います。文字通り、砂をふるって砂金を取り出すようなものです。矢守部長は20年以上前に、アメリカ国立がん研究所からスクリーニングのノウハウを学び、がん研独自に「JFCR39細胞パネル」を構築しました。「JFCR」はがん研究会の略称、「39細胞パネル」というのは、39人のがん患者から様々な性質を持つがん細胞を集めて培養し、パネル上に配置したもの、ということです。
ここに例えばAという化合物があるとします。Aをがん細胞39種類ぞれぞれに加えると、39通りの「Aによるやられやすさ」が分かります。この「やられやすさ」を偏差値に計算し直し、結果を1つの棒グラフにまとめたのが図の右側です。この棒グラフの形状を、「化合物Aのフィンガープリント」と呼びます。この作業を様々な化合物について繰り返すと、フィンガープリントの辞書(データベース)ができていきます。
重要なのは、フィンガープリントが似ていると薬の作用する仕組みもよく似ているということです。そこでZSTK474のフィンガープリントを採り、それに類似したフィンガープリントを持つ化合物を確かめていきました。そうして最も似ていたのが別のPI3キナーゼ阻害剤でした。これによりZSTK474もPI3キナーゼ阻害剤らしいと予測されたのです。後に生化学的実験によって、その仮説は証明されました。マウスを使った実験で体内での薬としての働きや安全性も確かめられ、抗がん剤として治験にこぎつけたというわけです。
個別化医療とバイオマーカー
新薬開発の今後の課題について、「患者一人ひとりのがんにあった薬物治療のためにも、新薬と抱き合わせで、その薬が有効かつ安全に使える患者を特定するバイオマーカーを開発していこう、というのが世界的な流れです」と矢守部長は言います。バイオマーカーとは、特定の薬の効きやすさや副作用の可能性等を示してくれる生体成分で、血液や細胞を調べることで分かるものです。
例えば、肺がんの特効薬と言われるイレッサは、EGFR(上皮成長因子受容体)の遺伝子に変異がある人に効くことが分かっています。つまり個々の肺がん患者のEGFR遺伝子変異の有無が、その人に対するイレッサの効果を予測する重要なバイオマーカーということになります。
とはいえ実際問題、新薬とバイオマーカーを同時に見つけていくことは、なかなか難しいことです。それでも前進あるのみ。矢守部長らも、個別化医療に貢献する重要な要素として、ZSTK474の効果を予測するバイオマーカーの探索にも力を入れています。
抗体薬と低分子化合物 がんの分子標的薬には、大きく分けて2種類、抗体医薬と低分子化合物があります。抗体医薬は、体が病原体などを排除する抗原抗体反応を利用した薬で、主にがん細胞の膜の表面にあるタンパク質が標的分子となります。標的以外への影響が少ないことから、副作用を予測しやすいとの利点があります。一方、医薬の大部分は低分子化合物です。低分子化合物は、分子量が小さいので膜を通って細胞内に入り、そこで作用する薬です。細胞内の狙った標的以外(様々な成分や細胞小器官)に作用する可能性もあり、副作用の予測が難しいのが難点です。
