がん医療を拓く⑫ がんの分裂を妨害 新たな薬の可能性
阻害剤SPLを開発
八尾主任研究員らのグループは2012年、がんモデルマウスで、TACC3を破壊するとがん組織が小さくなることを確認しました。
「遺伝子を改変することで胸腺リンパ腫を発症するマウスを作り、TACC3を欠損させたところ、リンパ腫が退縮しました。正常な胸腺では異常が起きなかったことから、TACC3は、がん細胞に特異的に発現している可能性が高いと考えられました」
つまりTACC3が、がん治療の有望な標的になるということです。八尾主任研究員らは阻害剤開発をめざし、理化学研究所の長田抗生物質研究室との共同研究に乗り出しました。
まず、長田研究室で開発したスクリーニング(ふるい分け)技術を用いて、6800個の低分子化合物の中からTACC3と結合する候補化合物を70個選び出しました。「これらの化合物が、細胞の中にまで入って本当に作用するかは確認できませんので、卵巣がん細胞に振り掛けて、細胞分裂を阻害するかどうか観察しました。4個の化合物が阻害効果を見せました」
卵巣がん細胞が選ばれたのは、がん研分子薬理部の持つ『がん細胞パネル』(2012年6月号参照)の39種類のヒトがん細胞のうち、卵巣がんと一部の大腸がんでTACC3が特に多く発現しているのを確認したためとのこと。
「得られた4個の化合物は、驚くほど似た骨格を持っていました。そこで基本骨格を明らかにした上で、派生形の化合物を人工的にたくさん作って、卵巣がん細胞にかけ、分裂が止まるかどうかを観察しました。こうして最もよく効くTACC3阻害剤、SPLの開発に成功したのです」
多極紡錘体を形成
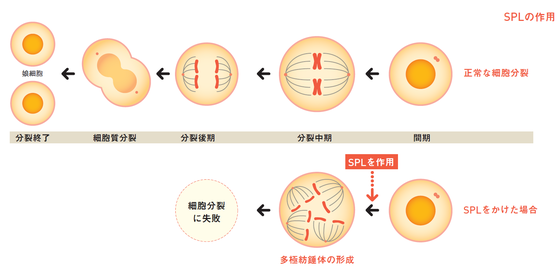
SPLは、どのような仕組みで抗がん効果をもたらすのでしょうか。
SPLをがん細胞に作用させてTACC3の働きを妨げると、正常なら分裂時に2極の紡錘体ができるところ、中心体・紡錘体が次々に生じると分かりました。これまでの微小管阻害剤とは全く異なる仕組みです。
さらに、卵巣がん細胞(TACC3高発現)が反応する濃度のSPLを正常細胞(TACC3低発現)にかけて観察しましたが異常は起きませんでした。SPLを経口投与されたがんモデルマウスでも、がんの増殖が大きく抑えられる一方で体重減少などの異常は見られませんでした。
このように、SPLや類縁化合物は、副作用の少ない抗がん剤となる可能性を大いに秘めています。製薬企業も関心を示しているそうで、臨床応用への準備が着実に進められています。
