がん⑦ 抗がん剤なぜ効くのか3
 抗がん剤特集の最終回は、これからの薬物療法をリードしていく分子標的薬です。抗がん剤治療のイメージを今後、大きく変えていくことになるかもしれません。
抗がん剤特集の最終回は、これからの薬物療法をリードしていく分子標的薬です。抗がん剤治療のイメージを今後、大きく変えていくことになるかもしれません。
監修/高橋俊二 がん研有明病院化学療法科原発不明がん担当部長
これまでご紹介してきた抗がん剤は、「細胞毒」と呼ばれるタイプと、性ホルモンの関与しているがんに効く「ホルモン剤」でした。そして今回、最後にご紹介するのが、「分子標的薬」です。10年ほど前、まったくもって新しいタイプの抗がん剤として登場し、あと10~20年もすれば、細胞毒系の抗がん剤に代わって薬物療法の中心になるだろうと言われています。新薬も続々と開発され、可能性の広がりに目が放せません。
そもそも分子標的薬の誕生は、1980年代から1990年代に、がんの分子生物学が進歩したことがきっかけでした。分子生物学とは、生命現象を分子レベル、つまり遺伝子やタンパク質の働きによって説明・理解すること目的とした学問です。がん細胞の増殖や転移に関しては、がんだけに見られる、あるいはがんで多く発現している異常なたんぱく質や酵素が重要な役割を果たしていることが分かってきました。その働きを制御できれば、がん細胞の増殖や転移を抑えられるはず。こうしたがん細胞に特異的あるいは過剰に発現し、がんの成長に関与している分子を見つけ、標的として攻撃する――それが分子標的薬です。
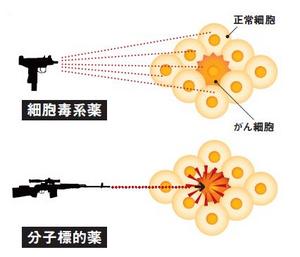 この考え方からすれば分子標的薬は、「正常細胞は攻撃せずに、がん細胞だけを狙い撃ちする」ことが可能です。実際、その点こそ細胞毒系の抗がん剤との大きな違いと言えるでしょう。最も分かりやすいのは副作用の現れ方ですが、次頁でご説明します。
この考え方からすれば分子標的薬は、「正常細胞は攻撃せずに、がん細胞だけを狙い撃ちする」ことが可能です。実際、その点こそ細胞毒系の抗がん剤との大きな違いと言えるでしょう。最も分かりやすいのは副作用の現れ方ですが、次頁でご説明します。
標的の違い 戦略の違い
では、分子標的薬が標的とする「がんに特異的な分子」としてはどんなものがあるのでしょうか。それによって薬剤を分類できます。
まずは「シグナル伝達経路阻害剤」と呼ばれるグループ。多くのがんでは、同じような細胞を際限なく増えさせる異常なシグナルが出続けています。シグナル伝達を担っている物質(典型例がEGFR。細胞表面にある成長因子受容体)に変異が起きているためです。そこでこの物質を標的とし、いちはやく結合してシグナル伝達を妨げ、がんの増殖を抑えようという戦略をとるのです。代表例としては、皆さんも名前を聞いたことがあるでしょう、イレッサ(ゲフィチニブ)やタルセバ(エルロチニブ)、グリベッグ(イマニチブ)などがこれに該当します。
次に「血管新生阻害薬」グループもあります。固形がんは自らの栄養補給のために勝手に血管を作り出すことが知られています(血管新生)。ですからこの血管が増えないようにすれば、がんは栄養を絶たれることになります。そこで、がん自身が産生している血管新生を誘導する物質(VEGF)もしくはその受容体に取り付いて働きを妨げ、がんをいわば兵糧攻めにして餓死させる作戦をとるのです。代表選手はアバスチン(ベバシズマブ)。ただし、アバスチンは単独でがんを小さくできず、細胞毒系の抗がん剤と併用します。新生血管を抑え込んで血管網を正常化させることで、抗がん剤ががんに届きやすくなり、治療効果が上がるのです。
このほか、DNAの断片によって突然変異を起こしたがん遺伝子の働きを妨害する「DNA」の研究も進められています。
また近年では、複数のタンパク質に作用するような分子標的薬(マルチターゲットドラッグ)も次々に誕生してきています。
なお、分子標的薬は薬そのものの性状によって分類することもでき、「低分子化合物」と、「抗体製剤(モノクローナル抗体)」に分けられます。
低分子グループの薬は分子量が小さいので細胞の中まで入っていくことができます。敵の懐に入って相手を内部から攻撃できるのです。イレッサやタルセバ、グリベッグなどはこの低分子化合物です。
一方、抗体製剤グループは、遺伝子工学を利用してつくられた人工の抗体です。抗体とは、体に進入した病原体などの異物(抗原)を撃退するために免疫系でつくられる物質。人工の抗体が、がん細胞にだけある特定のレセプターや情報伝達物質に取り付いて、その働きを阻害したりして効果を発揮します。有名どころではアバスチンのほか、ハーセプチン(トラスツズマブ)、リツキサン(リツキシマブ)などがあります。
