認知症を知る20 早期発見をめざし進化する画像診断
発症前から病気扱い
2011年4月、米国立老化研究所(NIA)と米国アルツハイマー病協会(AA)の合同委員会が、認知症とアルツハイマー病(以下ADと略記します)の新たな診断基準を発表、関係者の間で大きな話題になりました。
それまでの基準と大きく異なる点は、認知症発症前のADとして、軽度認知障害(MCI)、プレクリニカルADの2段階が提案されたことです(プレクリニカルADは臨床研究限定)。
MCIについては、2012年7月号でも軽く触れましたが
●物忘れがひどいと自覚があり、他の人からもそれを指摘されている
●記憶検査で年齢に比して異常な記憶力低下がある
●全般的な認知機能は正常
●運転や家計など日常生活の能力は保たれている
という状態です。これまでは病気未満という扱いだったのを、病気として扱うことになります。
では、さらに前のプレクリニカルADとは、どんな状態でしょうか。
アミロイド説から
この3段階分類は、ADの発症機序として現在最も広く受け入れられている「アミロイド・カスケード仮説」に基づいています。脳の中で、アミロイドβ前駆体タンパク(APP)→アミロイドβ(Aβと略記)→Aβが凝集して毒性を発揮→Aβ沈着(老人斑)→タウタンパク(コラム参照)蓄積→神経原線維変化→神経細胞減少、の流れが起きて認知症に至るという考え方です。
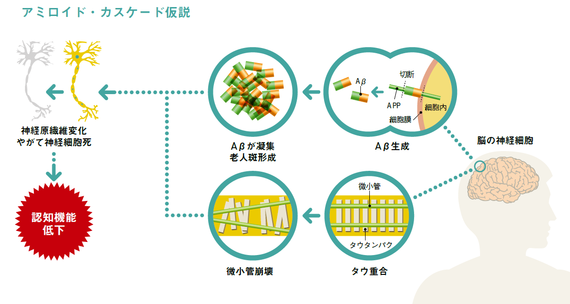 一般にAβの沈着は40歳代くらいから始まっており、認知症発症までには20~30年の歳月を要すると見られています。この、認知機能に全く異常はないけれどAβ沈着が始まっている状態を「プレクリニカルAD」と呼ぶことにしようというのです。
一般にAβの沈着は40歳代くらいから始まっており、認知症発症までには20~30年の歳月を要すると見られています。この、認知機能に全く異常はないけれどAβ沈着が始まっている状態を「プレクリニカルAD」と呼ぶことにしようというのです。
なぜ、そんな考え方が出てきたかというと、一つには診断技術の進歩があります。脳脊髄液中のAβ42量が減ってくると、脳にはAβが沈着し始めていると分かってきました。またPETを用いて脳にどの程度Aβが溜まっているか、可視化できるようになりました(アミロイドPETと呼ばれます)。認知症発症の15年ほど前から、蓄積を確認できるようになります。
もう一つの理由は、脳内のAβを減らすような根本的治療(疾患修飾性治療という言い方もします)薬候補がいくつも出てきて、Aβは減るのにADは改善しないという治験結果が繰り返されたことで、発症してからAβを減らしても遅いのでないか、もっと早くから治療を始めるべきでないかとの考え方が有力になってきたことです。初期ADでも、既に神経細胞は大量に死んでいるので、その前に何とかしたいということになります。
ただし、米国のADNI(*)という大規模研究で、健常高齢者の半数以上がアミロイドPETで陽性反応を示したという驚くべきデータもあり、これほど多くの無症状の人を病人扱いすることに社会の合意が得られるか分かりません。このためまずは、臨床研究限定で使われる病期となっています。
もう一つの標的「タウ」脳の神経原線維変化は、タウタンパクというものがリン酸化され重合して細胞内に溜まった結果として起きることが知られています。リン酸化を促進する大元がAβです。また動物モデルを使った研究では、糖尿病だとリン酸化が高まるようです。
神経細胞が死ぬことに直接関与している可能性が高いことから、Aβと同様に疾患修飾性治療薬のターゲットになっています。
2012年4月から、脳脊髄液中のリン酸化タウタンパク量測定が、認知症疑いの患者に対して1回だけ健康保険を使って行えるようになりました。ちなみにAβ42の測定は、まだ保険適用になっていません。
*ADNI 米国立衛生研究所(NIH)などを中心に2004年から行われているバイオマーカー探索の大規模臨床観察研究。最も信頼性の高い画像診断方法、認知機能検査、血液・髄液バイオマーカーの確定をめざしています。欧州や豪など各国でも同じプロトコルで研究が進められており、日本も07年度からJ-ADNIを行っています。