がん医療を拓く⑦ 全く新しい抗がん剤に道
ゴルジ体構造を破壊する?
ゴルジ体は、一枚の膜でできた扁平な袋が何層も積み重なった構造をしています。小胞体表面で合成されたタンパク質は、小胞体を経てゴルジ体の一番端の袋に取り込まれて、そこで成熟したタンパク質に変換されます。その際、ゴルジ体自体の構造がダイナミックに変化しながらタンパク質の成熟が進むと考えられています。(図参照)。
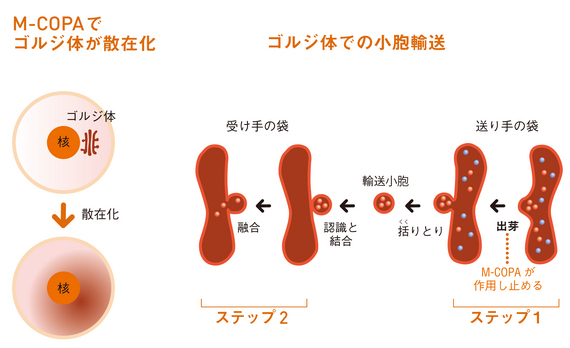 「M-COPAは、Arf1という分子標的に作用して、ゴルジ体の出芽(膜の一部がタンパク質を包み込んでくびれ、輸送小胞となること)を止めてしまうのです」とがん研化療センター分子薬理部の大橋愛美主任研究助手。「ゴルジ体は膜構造を維持できなくなって、細胞質に拡散することが確認できました」。その後、細胞自体もアポトーシスします。
「M-COPAは、Arf1という分子標的に作用して、ゴルジ体の出芽(膜の一部がタンパク質を包み込んでくびれ、輸送小胞となること)を止めてしまうのです」とがん研化療センター分子薬理部の大橋愛美主任研究助手。「ゴルジ体は膜構造を維持できなくなって、細胞質に拡散することが確認できました」。その後、細胞自体もアポトーシスします。
あくまでまだマウスでの実験段階ですが、「1日1回5日間の経口投与で、がんの増大を著しく抑制しました。副作用として軽い体重減少が見られましたが、投与期間後に順調に回復しています」とのこと。
ゴルジ体自体はどんな細胞にもあるので、普通に考えれば、正常細胞にもダメージを与え、副作用が出そうです。
それなのに顕著な副作用が認められなかった理由について、同部の旦慎吾副部長は仮説として「がん細胞は盛んにタンパク合成を行っています。その活動がゴルジ輸送に大きく依存しているならば、がん細胞のみにダメージを与える濃度幅がある可能性は考えられます」と説明します。「今後どういう条件を備えたがんに有効か見極めていくことで、分子標的抗がん剤としての実現可能性・実用性が高まるはずとの期待を込め、研究を進めています」
人工合成に成功
 ただし、M-COPAを実用化するには、もう一段大きな壁を越える必要がありました。土壌菌由来の希少な天然物を原料にしていたため、安価・大量に製造するのが困難だったのです。
ただし、M-COPAを実用化するには、もう一段大きな壁を越える必要がありました。土壌菌由来の希少な天然物を原料にしていたため、安価・大量に製造するのが困難だったのです。
 その大きな壁を打ち破ったのが、化学合成のスペシャリストである椎名勇・東京理科大学教授との共同研究でした。椎名教授が、このほど、独自の技術で安価な原材料から極めて効率よくM-COPAを人工合成することに成功したのです。この技術でM-COPAと似た構造の化合物の合成も可能となり、より優れた抗がん作用のものが見出されることも大いにあり得ます。この成果は薬化学分野の世界最高峰雑誌『Journal of Medicinal Chemistry』の表紙を飾り、会見にも多くの記者が詰めかけました。
その大きな壁を打ち破ったのが、化学合成のスペシャリストである椎名勇・東京理科大学教授との共同研究でした。椎名教授が、このほど、独自の技術で安価な原材料から極めて効率よくM-COPAを人工合成することに成功したのです。この技術でM-COPAと似た構造の化合物の合成も可能となり、より優れた抗がん作用のものが見出されることも大いにあり得ます。この成果は薬化学分野の世界最高峰雑誌『Journal of Medicinal Chemistry』の表紙を飾り、会見にも多くの記者が詰めかけました。
しかも、M-COPAや類似化合物は安価に製造できそうです。研究チームは、今回見出したM-COPAの全合成技術を利用して、ゴルジ阻害剤という新たなジャンルの抗がん剤開発につなげたい考えです。
