国内未承認の抗がん剤を迅速に保険適用へ
■ 厚労省課長の説明③
[保険局医療課・鈴木康裕課長]
それから2点目、またちょっと戻って恐縮ですけれども、7ページをご覧いただきたいと思います。
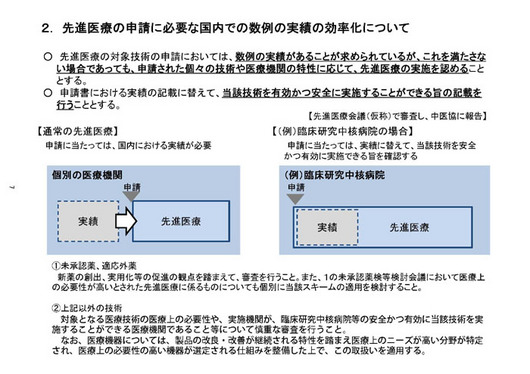 これもポンチ絵が真ん中に描いてありますけれども、現在のところが左側。一部について今度は新しく右側を導入してはどうかということでございます。
これもポンチ絵が真ん中に描いてありますけれども、現在のところが左側。一部について今度は新しく右側を導入してはどうかということでございます。
中身は何かと申しますと、現在は先進医療を申請していただく際には、実際の実績というのが求められています。ここの部分については、保険の給付外の併用というのが認められておりませんので、実質上全額、施設側の負担で実績をつくっていただいた上で申請していただく、こういうシステムになっているわけですけれども......。
そのうち、いくつかの機関、ここでは例として臨床研究中核病院......、先ほどちょっと申し上げましたけれども......、というような所で実施できていただいて、技術の安全性が......。
安全であり、かつ有効であるということが一定程度確認ができた場合には、実績づくりも含めて、実際に保険外の併用療法をしていただくという仕組みを導入してはどうだろうと。
つまり、実績がない段階で申請をしていただくことでも可能としてはどうかということ。これは全部ではございません。一定の安全かつ有効な技術で、臨床研修中核病院で実施されるものということで......。
(資料)下の方に、薬の場合、それ以外の技術の場合というのが少し文章編で書いてございます。これが2点目でございます。それから3点目でございますけれども、ページで言いますと、8ページをご覧いただきたいと思います。
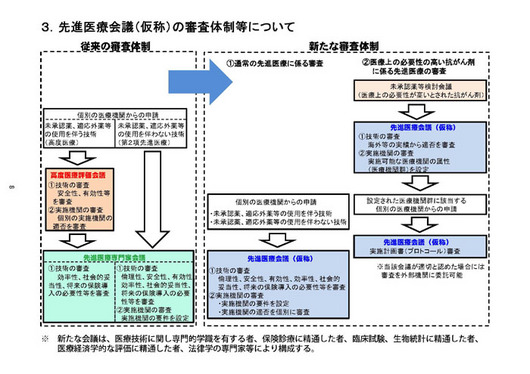 これも左側が現在の体制。右側がこれから新しい審査体制はこういうふうに考えたらどうだろう......、これも一度ご議論いただいておりますけれども......。
これも左側が現在の体制。右側がこれから新しい審査体制はこういうふうに考えたらどうだろう......、これも一度ご議論いただいておりますけれども......。
どういうふうになっているかと言うと、現在は明確に未承認薬・適応外薬等、実際上、薬事法上認められていない技術を使う場合......。
これは2段階になっておりまして、(厚労省医政局の)「高度医療評価会議」というものをまず実施した上で、さらに(同保険局の)「先進医療専門家会議」......。
これはいずれも(資料)後ろに(委員)名簿が載っておりますけれども、ここで2段階で議論をした上で実際に審査を行う。それ以外のものは「先進医療専門家会議」一本で審査を行うということでございますけれども......。
新しい体制は、これを1つの会議にさせていただいて、通常の先進医療......、それから先ほどもちょっと申し上げた抗がん剤にかかる先進医療、少し分けた形でございますけれども......。
いずれにしろ2つ会議を分けるのではなくて、1つの会議で検討していただくということで、実際に、ある意味で言うと、会議の回数等々で節約ができるのではないかと思っております。
以上3点、既に7回目までにご議論を頂いていることでございますけれども、もう一度、ポンチ絵等で示させていただきました。
本日は、おおむねこれにご了解いただければ、あとは事務的な作業を進めさせていただきたいというふうに思っております。以上です。
[森田朗会長(東京大大学院法学政治学研究科教授)]
はい、ありがとうございました。ただ今のご説明について、ご質問、ご意見......、はい、嘉山委員どうぞ。
【目次】
P1 → 厚労省課長の説明①
P2 → 厚労省課長の説明②
P3 → 厚労省課長の説明③
P4 → 「非常に進歩したと評価したい」 ─ 嘉山委員
P5 → 「審査の効率化、重点化はいい」 ─ 小林委員
P6 → 「現在の評価基準を総会で議論して」 ─ 安達委員
P7 → 「公正性を担保するような制度にして」 ─ 花井委員
P8 → 「お金を払えば受けられるようになるのか」 ─ 西村委員
