再生医療の運営費、年3000万円超
-thumb-270x386-833.jpg) 「再生医療における制度的枠組みに関する検討会」は、昨年12月に政府の規制改革会議が示した「第3次答申」を受けて設置された。
「再生医療における制度的枠組みに関する検討会」は、昨年12月に政府の規制改革会議が示した「第3次答申」を受けて設置された。
各省庁に対し、規制の緩和や撤廃を求める「規制改革のための第3次答申」では、医療分野の具体的施策として、「ライフサイエンス分野」「IT化の推進」「医薬品」「医師と他の医療従事者の供給体制」「評価療養制度」―などを挙げている。
答申は「ライフサイエンス分野」の中で、「医工連携(医師とエンジニアの役割分担)」として、「自家細胞等による加工物の外部委託(医療機関含む)についても、現行の法体系の中でどう取り扱うかが不明確であるとともに薬事法違反となるか否かが十分に明瞭ではない」と指摘。
「実際は可能な場合があるにもかかわらず、自家細胞培養施設のない医療機関が再生・細胞医療を提供できないとの強い懸念がある。これは、医療法(昭和23年法律第205号)と薬事法の適用範囲が明確でないことが原因であり、このような状況を解消する施策を早急に実施すべき」としている。
その上で、臨床研究段階で医師の立ち会いがなくても細胞の培養・加工が可能となるようガイドラインを改正すること(平成21年度措置)や、ある医療機関が患者から採取した細胞を別の医療機関で培養・加工して患者に投与できるよう医療法上の条件を示すこと(平成21年度措置)、臨床研究から実用化への流れをつくる制度的な枠組みを決めること(平成22年度結論)などを求めている。
 同日の会合で、厚労省は「再生・細胞治療における共同での診療」(平成21年度措置)について今後の議論のたたき台を示した。
同日の会合で、厚労省は「再生・細胞治療における共同での診療」(平成21年度措置)について今後の議論のたたき台を示した。
検討項目は、(1)加工医療機関に設置されるCPCの施設基準(2)CPCの人員基準(3)共同で診療を行う上での安全対策(4)倫理審査やインフォームド・コンセントの在り方(5)細胞を培養・加工した結果の公開―の5点。
患者から細胞を採取して培養・加工し、投与するという一連のプロセスを1つの医療機関だけで完結せずに、CPCを持つ他の医療機関と協力して行えるようにするため、薬事法や医療法など現行制度の枠内で実施するためのルールを策定する。第一段階として、1人の患者に対し複数の医療機関が共同で医療を提供する「共同診療」という枠内で検討する。
たたき台ではまた、医療機関に設置したCPCの実態調査を提案している。同日の会合では、国内の医療機関CPCの実態調査を森尾友宏委員(東京医科歯科大大学院准教授、細胞治療センター長)が担当することを決めた。
この検討会は、2か月ごとに2011年2月まで12回にわたり開催し、今年度中に措置する事項については来年2月に結論を出す。次回は、6月に開催する予定。
【再生医療】
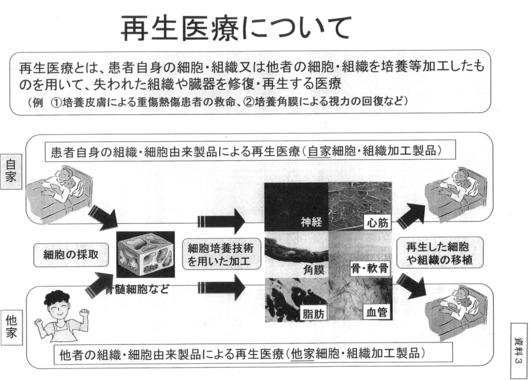
厚生労働省によると、再生医療とは「患者自身の細胞・組織または他者の細胞・組織を培養など加工したものを用いて、失われた組織や臓器を修復・再生する医療」で、培養角膜による視力の回復などを具体例として挙げている。
加工した細胞や組織を使って作られた神経や角膜などには「自家」と「他家」があり、患者自身の組織や細胞に由来した製品による再生医療を「自家細胞・組織加工製品」、他者の組織や細胞に由来した製品による再生医療を「他家細胞・組織加工製品」としている。

>臓器移植や人工臓器に代わる切り札として注目される「再生医療」
iPS細胞やES細胞などは、いくつかのトライアルのうち一部が組織レベルで分化が認められたレベルに過ぎず、臓器への分化や発がん性の問題などまだまだ克服すべき課題が多いようですね。(マウスだかラットの背中に耳介を作った写真を見た覚えはありますが、きちんと機能する臓器はまだまだ先ですね。)
私はむしろ、ヒトに対する抗原性タンパクをノックアウトしたクローン動物(ミニブタなど)を更に改良した「異種移植」が臨床的には実現可能性としては早いのではないかと個人的には予想しています。あまり抵抗感がなく、急性拒絶反応時にもリカバーしやすい臓器や組織から、まずは始まるのではないかとは思いますが。