先発品企業が命運を託す「薬価維持特例」(2)―意見陳述(ファルマ等)
【スライド4―最近のR&D環境は劇的に変化】
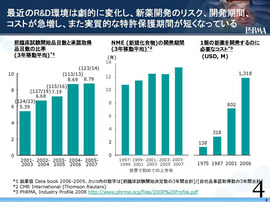 これは、最近の新薬の開発状況をいくつかのデータで見たもの。
これは、最近の新薬の開発状況をいくつかのデータで見たもの。
棒グラフが3つあって、ちょっとごちゃごちゃしているが、左側の棒グラフは新薬開発のリスク。1つの物質が、承認取得に必要な候補物質数を示した。1つの承認を得るために必要な候補物質数は、どんどん増えている。開発の難しさ、リスクが増えていることを示している。
真ん中の棒グラフは、新規化合物の開発期間。これがまた、ずーっと増えていて、2005年から07年は13年以上掛かっている。
さらに、一番右端のグラフはコストを表している。1つの新薬を開発するのに必要なコストがすーっと増えてきた結果、2006年では約13億ドル、1300億円にも達している。これだけ、新薬を開発するための環境が厳しくなっているということが示されている。
次のスライドをお願いします。
【スライド5―研究開発における選択と集中に全力】
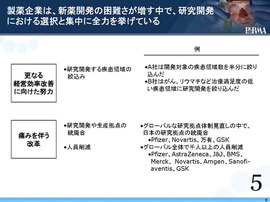 こうした厳しい環境の中で、製薬企業は現在、研究・開発の選択と集中に全力を挙げて取り組んでいる。
こうした厳しい環境の中で、製薬企業は現在、研究・開発の選択と集中に全力を挙げて取り組んでいる。
そういう中で、世界市場における日本市場の魅力が減ってきていることが大変懸念される。
外資系企業では、開発拠点を日本に置き続けることが本当に妥当なのかと、あるいは今後、どれだけの開発投資を日本にしていくべきかということが今、検証されているのが現実的な問題。
次のスライドをお願いします。
【スライド6―薬価制度が開発・上市に影響】
 これは、日米欧の主要12社にファルマからヒアリングして作ったスライド。統計的に網羅したということではなく、一部定性的と理解いただきたい。
これは、日米欧の主要12社にファルマからヒアリングして作ったスライド。統計的に網羅したということではなく、一部定性的と理解いただきたい。
結果として、過去10年間に日本の非常に低い薬価制度が理由で開発・上市を中止した、あるいは遅延したといわれる製品が約23個あった。
日本の薬価制度がドラッグ・ラグに関係しているということを示す資料になっている。
次のスライド、7ページ。
【スライド7―薬価維持特例の導入が必要】
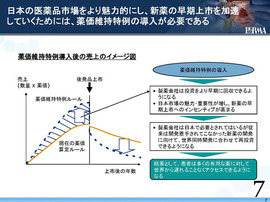 これは既に日薬連さんが十分に説明したので省略するが、私どもファルマとしても、日本の医薬品市場の魅力を取り戻し、かつ新薬の早期上市を加速していくためには、この「薬価維持特例」の導入が絶対必要であると強く考えている。
これは既に日薬連さんが十分に説明したので省略するが、私どもファルマとしても、日本の医薬品市場の魅力を取り戻し、かつ新薬の早期上市を加速していくためには、この「薬価維持特例」の導入が絶対必要であると強く考えている。
では、そういう薬剤を「薬価維持特例」の対象とすべきか。
先程、日薬連さんが説明したが、私どもは数字で説明したい。それが8ページ。
【スライド8―平均乖離率より薬価差低い新薬は売上高小】
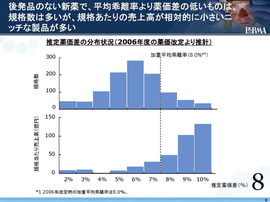 これは、薬価差と成分数とを調べたもの。
これは、薬価差と成分数とを調べたもの。
今、業界が提案している薬価差の「加重平均乖離率」。
そこで、「薬価維持特例」に入るものと入らないものとを分けたときにどうなるかを調べた。
実は、「薬価維持特例」に入るものは規格数では多い。
しかし、1つひとつの製品の薬価差は非常に小さくて、規格当たりの売上高も小さい。規格数は多いが、規格当たりの売上高が非常に低いニッチな製品が多い。
次は、9ページ。
【スライド9―希少疾病用医薬品は「加重平均乖離率」以下】
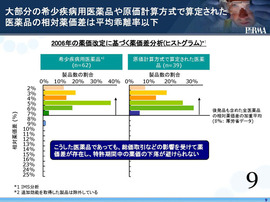 オーファンドラッグ(希少疾病用医薬品)、あるいは原価計算方式で算定された医薬品など、競争があまりないような製品では、「加重平均乖離率」の中に入っている。
オーファンドラッグ(希少疾病用医薬品)、あるいは原価計算方式で算定された医薬品など、競争があまりないような製品では、「加重平均乖離率」の中に入っている。
「加重平均乖離率」を使うことの意味が、これで検証されたのではないかと考える。
次は、後発品の使用促進について説明する。
