先発品企業が命運を託す「薬価維持特例」(2)―意見陳述(ファルマ等)
【スライド11―市場拡大再算定はイノベーションの促進に逆行】
ファルマは従来から、「市場拡大再算定」、効能追加などによる再算定、制度全般について一貫して反対してきた。これらは、革新的で成功した医薬品に対して「薬価引き下げ」というペナルティーを科すものであり、「イノベーションを促進する」という制度の考え方にも反する。
本日は、「市場拡大再算定」についてお話をさせていただく。
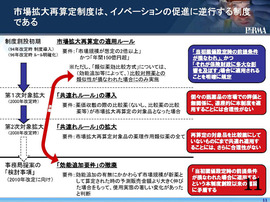 11ページの一番上に書いてあるが、「市場拡大再算定制度」は、ある医薬品の売上げが、「当初の想定の2倍以上」、かつ「年間150億円超」、そして、「類似薬効比較方式」で薬価が決められたものについては、効能追加という比較対照薬との類似性が損なわれたときに初めて使われている。
11ページの一番上に書いてあるが、「市場拡大再算定制度」は、ある医薬品の売上げが、「当初の想定の2倍以上」、かつ「年間150億円超」、そして、「類似薬効比較方式」で薬価が決められたものについては、効能追加という比較対照薬との類似性が損なわれたときに初めて使われている。
これに関するご当局の説明としては、「当初薬価設定時の前提条件が損なわれ」、かつ「それが保険財政に多大な影
響を及ぼす」場合に適用されるということだった。
しかしながら、この制度は創設以来、数度にわたってわれわれ研究・開発型の製薬企業のイノベーションの意欲をそぐ方向で改悪が行われてきているのではないか。
まず、2000年に導入された、いわゆる「共連れルール」。これは、ある医薬品が再算定の対象になると、それを比較薬として算定された薬剤はすべて再算定の対象となる。個々の医薬品の価値や革新性などに対する考慮がなされていない、非常に非合理的なルールと考える。
2008年、前回の薬価改定では、「共連れルール」がさらに拡大された。ある医薬品の薬価が、「市場拡大再算定」の対象となった医薬品の薬価に全く無関係に算定された場合であっても、その医薬品が対象薬と類似する薬理作用分類である限りにおいては、薬価が切り下げられてしまう。まさに、個々の医薬品の革新性を全く考慮しない、著しく非合理なルと言える。
さらに今回、当局から2010年度、次回の薬価改定の時に、薬価制度改革で検討する事項として、「効能追加の有無にかかわらず市場規模が新薬として算定された時の予測販売金額より大きく伸びた場合をもって、使用実態の著しい変化があったと判断する」ということが提起されている。
L-thumb-270x187-1766.jpg) 先程、申し上げた通り、私どもファルマとしては、「市場拡大再算定制度」に対しては一貫して反対してきているが、これまで、当局からの「市場拡大再算定制度」の趣旨に対する説明は、「当初薬価設定時の前提条件が損なわれ」、かつ「それが保険財政に多大な影響を及ぼす」場合に適用されると理解していたが、これでは、当初の当局のご説明に対しても矛盾してくる。
先程、申し上げた通り、私どもファルマとしては、「市場拡大再算定制度」に対しては一貫して反対してきているが、これまで、当局からの「市場拡大再算定制度」の趣旨に対する説明は、「当初薬価設定時の前提条件が損なわれ」、かつ「それが保険財政に多大な影響を及ぼす」場合に適用されると理解していたが、これでは、当初の当局のご説明に対しても矛盾してくる。
効能追加の有無にかかわらず、「市場拡大再算定」を適用することは、われわれ、到底これに賛成できない。受け入れられないということ。
こうなってくると(効能追加要件を撤廃すると)、この(市場拡大再算定)ルールそのものが、保険財政上の政策で、すなわち、単純にたくさん売れた製品に関しては一定の貢献を強いる制度として運用されていくのではないかと懸念している。
われわれとしては、このような薬価ルールは、単なる財政対策の発想ではなく、医師や患者さんのニーズに応えて、使用頻度が高く、治療用途が幅広く成功した医薬品をどのようにこれから配置していくのか。患者さんのためにイノベーションをどう促進していくのか、そういった視点から、きちんと在るべき制度を議論していくべきだということを、この場を借りてお願いする。
ファルマとしての意見陳述を終わらせていただく。ありがとうございました。
[遠藤部会長]
どうもありがとうございました。それでは引き続き、エフピアからよろしくお願いしたい。
