先発品企業が命運を託す「薬価維持特例」(1)―意見陳述(日薬連)
■ なぜ、薬価制度改革が必要か
【P6・未承認薬・未承認適応及びドラッグ・ラグの問題】
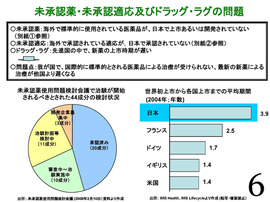 中医協の場においても、「未承認薬・未承認適応及びドラッグ・ラグの問題」について、たびたび議論していただいた。
中医協の場においても、「未承認薬・未承認適応及びドラッグ・ラグの問題」について、たびたび議論していただいた。
(厚労省の)「未承認薬使用問題検討会議」で対応が必要とされた成分は、巻末の参考資料に示しているが、2009年2月末現在で44成分ある。
左図に示すように、このうち20成分は既に承認(薬価収載)されているが、24成分が未承認。
また、右の図に示すように、日本では研究・開発に長時間が掛かる結果、先進国中で新薬の上市時期が遅く、ドラッグ・ラグの問題が起こっている。
こうした未承認薬・未承認適応およびドラッグ・ラグの問題解決のため、業界では次のページのような取り組みを行っている。
【P7・未承認薬・未承認適応及びドラッグ・ラグ解消のための対策】
 未承認薬・未承認適応への対応としては、製薬業界が「未承認薬等開発支援センター」を設立した。後程、製薬協の庄田会長より説明する。
未承認薬・未承認適応への対応としては、製薬業界が「未承認薬等開発支援センター」を設立した。後程、製薬協の庄田会長より説明する。
ドラッグ・ラグへの対策は、(厚労省の)「革新的医薬品・医療機器創出のための5か年戦略」において、臨床研究・治験環境の整備、承認審査の迅速化・質の向上などを官民で取り組んでいる。
2011年度までに開発期間、審査期間の2.5年の短縮を目指している。
さらに、未承認薬・未承認適応およびドラッグ・ラグの両方を解決するための対策として、革新的新薬に対して、その価値を評価し得る制度を提案している。
【P8・薬価制度改革の必要性】
(P8の中の)左の図を見ていただくと、横軸に研究・開発、販売期間を、縦軸に金額を示している。研究・開発期間中は、研究・開発投資だけが先行するので、常にカーブがマイナスを続ける。
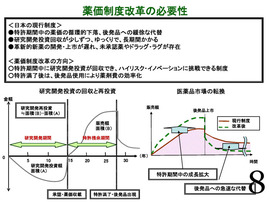 約15年が経って製品が上市されると、カーブは初めてプラスに転じる。その後、特許が満了すると後発品への置き換えにより販売額は低下する。
約15年が経って製品が上市されると、カーブは初めてプラスに転じる。その後、特許が満了すると後発品への置き換えにより販売額は低下する。
「特許残余期間中の販売額」の面積(B)が、「研究開発投資額」の面積(A)と少なくとも同等か、あるいはそれ以上でないと、研究・開発への再投資はできない。
右の図は、日本の現行制度の特徴。
薬価の循環的な下落、後発品への甘受な代替であるために、研究・開発投資(額)の回収が少しずつゆっくりで、長期間かかっている。
今回、提案した薬価制度(改革案)では、特許期間中に研究・開発投資(額)を回収でき、ハイリスク・イノベーションに挑戦できる制度にすることにより、患者さんや医療現場のニーズである「アンメット・メディカル・ニーズ」に対応した革新的新薬の上市ならびに未承認薬、ドラッグ・ラグの解消を促進することを目指している。
なお、特許満了後は後発品使用により、薬剤費の効率化を図ることを同時に提案している。
それでは次いで、製薬協の庄田会長より、「未承認薬等開発支援センター」および「薬価維持特例」について、ご説明する。
