先発品企業が命運を託す「薬価維持特例」(1)―意見陳述(日薬連)
■ 未承認問題へ、業界横断的な取り組み
【P9・「未承認薬等開発支援センター」の設立】
製薬協の庄田です。私からは、未承認薬問題の解決に向けた業界としての取り組み、ならびに提案している「薬価維持特例」の概要について、お話をさせていただく。
 まず、未承認薬問題の解決に向けた業界としての取り組み。9ページをご覧いただきたい。「未承認薬等開発支援センター」について、ご説明する。
まず、未承認薬問題の解決に向けた業界としての取り組み。9ページをご覧いただきたい。「未承認薬等開発支援センター」について、ご説明する。
冒頭、日薬連・竹中会長が説明した通り、私ども製薬産業はその使命に基づき、必要な医薬品を患者・国民の皆様に提供するための努力を続けている。
しかしながら、これらの医薬品の中には、患者さんの数がごく限られているもの、個々の企業ではなかなか開発着手が困難なものも少なくない。
未承認薬等の開発に関する問題を解決するためには、この未承認薬に取り組む個々の企業に対して、その研究・開発から製造・販売までの各段階において、業界横断的に、専門的、薬事的、技術的な支援、あるいは資金的な援助を行い、当該企業の負担やリスクを分散、軽減することが必要であると考えた。
そこで、製薬協加盟の各社の参加の下で、非営利の団体として「未承認薬等開発支援センター」を立ち上げ、この問題の早期解消に新たな取り組みを進めることにした。
具体的な事業内容、ならびに組織は資料9ページにある通り。この「未承認薬等開発支援センター」は、一般の社団法人として5月29日に法人登記した。
【P10・未承認薬等開発支援センターによる対応スキーム】
「未承認薬等開発支援センター」がどのようにワークするかという図。
まず、上の方の緑色。患者団体、学会からの要望について今後、厚生労働省が設置する「有識者会議」で治験開発が検討される未承認薬または未承認効能に取り組む。
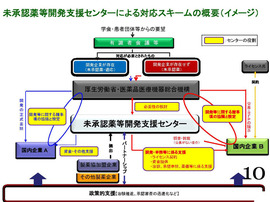 未承認適応の場合には、既に当該医薬品を別効能で販売している企業が存在する。また、外国で当該医薬品を販売している企業の日本法人がある場合もある。
未承認適応の場合には、既に当該医薬品を別効能で販売している企業が存在する。また、外国で当該医薬品を販売している企業の日本法人がある場合もある。
このように、開発企業が存在するケースもあるが、これについては当該企業が治験を促進するための支援を行っていきたい。
一方、大変問題となっているのは、日本にそのような企業が存在しない場合、開発企業を募集することになるが、実際にはなかなか個別企業としては開発できないということで、応募が少ないのが現状。
この「未承認薬等開発支援センター」では、募集の時点から支援内容を示すので、応募を促すことができる。また、開発企業が決まったら、開発・治験あるいは申請に関する支援を業界横断的に行っていきたい。
未承認薬等の問題には、さまざまな日本の制度的な要因も含まれている。この支援センターと厚生労働省およびPMDA(医薬品医療機器総合機構)とパートナーシップを結んだ上で、特に行政には政策的な支援もお願いしたい。
もう1ページ、さらに詳しく支援センター機能を紹介する。
【P11・未承認薬等開発支援センターの機能】
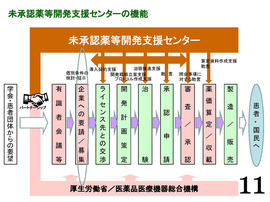 未承認薬の開発企業の募集に際しては、「未承認薬等開発支援センター」と、さらには厚労省、また実際に企業が決定したら、具体的な開発プロセス、条件、支援内容の協議を行う。
未承認薬の開発企業の募集に際しては、「未承認薬等開発支援センター」と、さらには厚労省、また実際に企業が決定したら、具体的な開発プロセス、条件、支援内容の協議を行う。
「未承認薬等開発支援センター」では、例えばその未承認薬を海外の企業が開発した場合、そのライセンス元との交渉の支援、あるいは開発戦略、あるいは治験のプロトコールの作成などのノウハウ提供、あるいは申請時、あるいは薬価収載時には、業界全体での経験を生かした助言を行う。
また、柔軟に充てられるような資金提供も、このセンターから行いたい。
このように、患者・国民の皆様が望んでいる未承認薬等の問題解決を図っていきたい。
