薬価維持特例の試行的実施に向けて (3)
■ 「海外で稼いだ利益を日本に納税している」 ─ 長谷川社長
[長谷川閑史・武田薬品工業社長(日本製薬工業協会副会長)]
ご紹介いただきました武田薬品の長谷川でございます。ただ今、遠藤会長からお話がありましたように、前回(6月3日)の中医協に、日薬連(日本製薬団体連合会)会長、製薬協(日本製薬工業協会)会長ともども出席し、私どもの立場を説明し、委員の皆様からのご質問にもお答えしたが、まだ論議を尽くしていないということで、本日このような場を設けていただいたことを感謝申し上げる次第でございます。
前回も申し上げた通り、必要であれば何度でも説明にお伺いする用意がありますので、今後とも遠慮なくお申し付けいただければ幸いであります。本来であれば、日薬連、製薬協の代表が出席すべきところですが、拠所ない事情により出席できないということで、竹中日薬連会長および庄田製薬協会長のご指示により、これらの組織を代表して出席するということになった次第でございます。
本日は、お手元にお配りした資料に基づいて、お話を大体15分ぐらいでまとめさせていただきたいと思う。(資料の)グラフのページ(国内製薬企業の経営状況)を開けていただきたい。
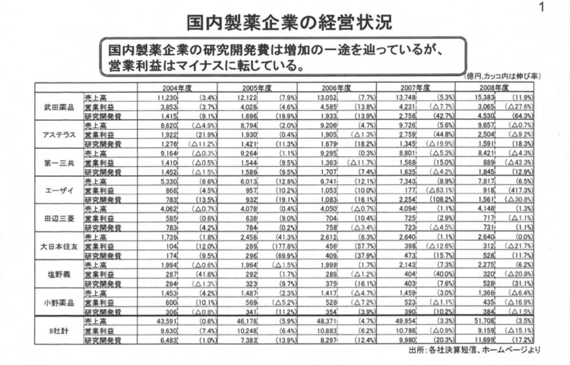 研究開発型製薬企業は、内資・外資を問わずグローバルな研究開発競争に直面しており、国内企業の研究開発費も、ここ(資料)でご覧いただくように増加している。
研究開発型製薬企業は、内資・外資を問わずグローバルな研究開発競争に直面しており、国内企業の研究開発費も、ここ(資料)でご覧いただくように増加している。
これは、医薬品研究開発費の高騰に加え、各社とも競争に勝ち残るために一定規模以上の費用を研究開発に投じていることにもよるものであるし、また医薬品産業そのものも技術革新の壁にぶつかっており、レギュレーション(規制)も厳しくなってきている。
そういった意味から、(新薬開発の)成功確率のハードルが非常に高くなっている、あるいは要求される治験の規模も大きくなっている。それらが相まって、こういうこと(研究開発費の増加)の背景にある。次のページ(製薬産業および主な製造業の研究開発費と営業利益)をご覧いただきたい。
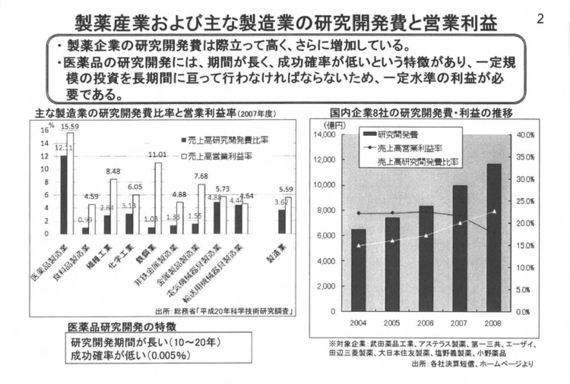 製薬企業の研究開発費の比率および額の格差はこれまでも申し上げてきたが、研究開発費の比率は業種によって異なるので一概に申し上げられないが、例えば、装置型産業においては多額の設備投資を行い、生産性や効率性を上げることによってコスト競争力を高めてリターンを取るビジネスモデル。
製薬企業の研究開発費の比率および額の格差はこれまでも申し上げてきたが、研究開発費の比率は業種によって異なるので一概に申し上げられないが、例えば、装置型産業においては多額の設備投資を行い、生産性や効率性を上げることによってコスト競争力を高めてリターンを取るビジネスモデル。
一方、医薬品産業は研究開発の期間、すなわち投資期間が長く、成功確率が低いという特徴がある「ハイリスク・ハイリターン」タイプのビジネスモデル。
一般的に言えば、製薬企業の研究開発費のうち約6割が開発費であり、残りの4割が研究費というのが平均的なところだと思われるが、4割の研究費のうち2~3割は外部研究機関への研究委託や共同研究に割かれているものと平均的には思われる。
大ざっぱに申し上げて、1製品に掛かる開発費全体の約1割がフェーズ1(臨床試験の第一段階)、約2割がフェーズ2、そして残りの約7割がフェーズ3に投下されているものと思われる。従って、開発後期の製品が失敗に終わると、コスト面でも製品戦略面でもダメージが大きい。
近年の規制強化あるいは技術革新に伴う、この(フェーズ3)段階での中止や、さらなる追加試験の要求に伴う追加コストと承認の遅れは、企業にとって大変、大きな負担になってきている。次(のページを)お願いします。
 製薬企業はグローバルな研究開発競争を勝ち抜くために、これまでもさまざまな政策を実施して生き残りを図ってきた。ここにお示ししたのは、その例の一部。
製薬企業はグローバルな研究開発競争を勝ち抜くために、これまでもさまざまな政策を実施して生き残りを図ってきた。ここにお示ししたのは、その例の一部。
特に2000年代に入り、各社の経営統合も行われたほか、当社の武田薬品においても医薬外事業を10年間かけて譲渡してきたし、従業員の雇用や労働条件を確保しつつ、事業譲渡を行うということは......、それでも同じ会社で一緒にやってきた従業員の方に転籍を要請するということで、経営者にとっては誠に辛い決断だったが、そういったいわゆる事業の再構築を経て、今日の姿に至っている。
ここに挙げた政策を実施する当たっては、各社の経営者はそれぞれ大変な思いをしながら実施してきたと思われるし、今後も高騰する研究開発費を賄うためには、継続してこういった事業の体質強化を行っていく必要があると考えている。次のページ(製薬企業における従業員数の推移)をお願いいたします。
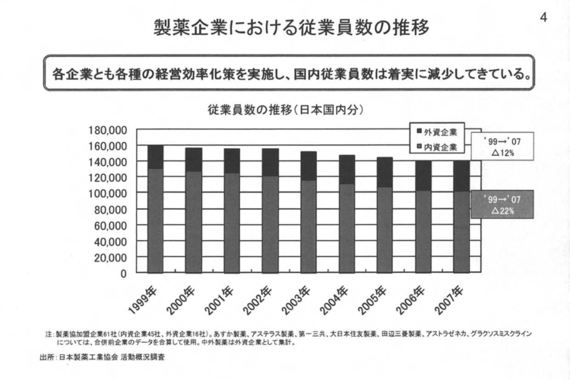 前ページで述べた政策に加えて、体質強化のための人員適正化、削減策を講じたことにより、製薬企業の従業員数は減少してきている。それでも産業全体では14万人、国内企業だけでも10万人規模の雇用を日本国内に創出しているのが実態。次のページ(機能別にみた国内製薬企業の役割)をお願いいたします。
前ページで述べた政策に加えて、体質強化のための人員適正化、削減策を講じたことにより、製薬企業の従業員数は減少してきている。それでも産業全体では14万人、国内企業だけでも10万人規模の雇用を日本国内に創出しているのが実態。次のページ(機能別にみた国内製薬企業の役割)をお願いいたします。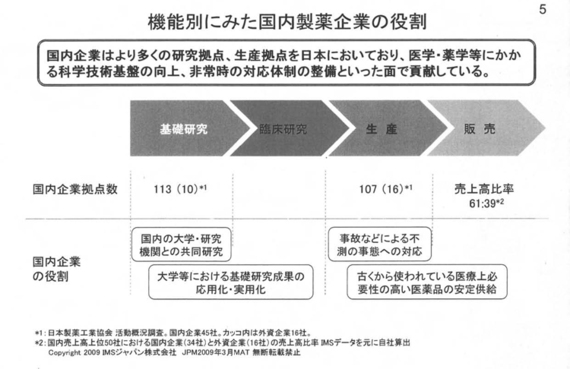 企業が生き残るためには、環境変化を先取りし、自ら変化していくことが求められるが、国内企業はより多くの研究拠点、生産拠点を日本に置いている。
企業が生き残るためには、環境変化を先取りし、自ら変化していくことが求められるが、国内企業はより多くの研究拠点、生産拠点を日本に置いている。
これ(資料)は対外資との比較だが、医学・薬学等にかかる科学技術基盤の向上、非常時の対応体制の整備といった面でも貢献していると自負している。
(前回7月15日の薬価専門部会で、日本医師会の中川俊男常任理事から)「国内企業がなくなって外資系企業だけになったらどうなるか」とのご質問があったとのことだが、この質問に単純にお答えするとすれば、約10万人の雇用と約4000億円の税収が失われるということになる。
もちろん、失われた雇用や税収の一部は外資系の企業が埋め合わせることになると思うが、それは(日本企業)創出分の半分にも達しないのではないかと思われる。
内資の場合は生産拠点も持たないし、また(多国籍企業の場合は)「トランスファー・プライス」(租税回避のための価格操作)により、日本に落ちる利益よりも本国に落とす利益のほうが多いとか、いろいろな事情があるので、大ざっぱにいけば、(約4000億円の税収が失われるということは)「中らずと雖も遠からず」ということではないかと思う。
加えて、日本が誇る科学技術の重要分野の1つであり、欧米のみならずアジアにおけるシンガポールやインドなどでも国家戦略として力を入れているライフサイエンス分野での日本は、大きく遅れを取ることになることも懸念される。
さらには、日本の製薬企業の大手4社、武田、アステラス、第一三共、エーザイは平均すると50%以上の売上および利益を海外で上げており、海外で稼いだ利益をOECDの中で最も法人税率の高い日本に持ち帰って納税しているという意味で、そういった貢献もしていると自負している。
なお、「現行制度のままで行けば、5年から10年後には経営が成り立たなくなる」ということを業界側委員が述べたように聞いているが、経営者の観点から見て、そのような相関関係、「この制度がなければわれわれが潰れる」ということを申し上げるつもりは一切ない。そのために、制度改定を提案しているわけではない。
既に売上げ利益の半分以上を海外で上げている企業もあり、仮に国内市場で淘汰されても生き残りは図れると思う。われわれは、自分たちの将来がお先真っ暗だから薬価制度改定を提案しているわけではない。
新薬メーカーとジェネリックメーカーの棲み分けを促進し、それぞれのビジネスモデルの中で体質強化をしていくことによって、日本企業にとって本当の競争相手である海外企業とグローバル市場で闘って勝ち取った富を日本に持ち帰ってくることによって、日本の繁栄にも貢献できるとの想いから、こういう提案を申し上げている。次のページ(製薬企業のパイプラインの状況)をお願いいたします。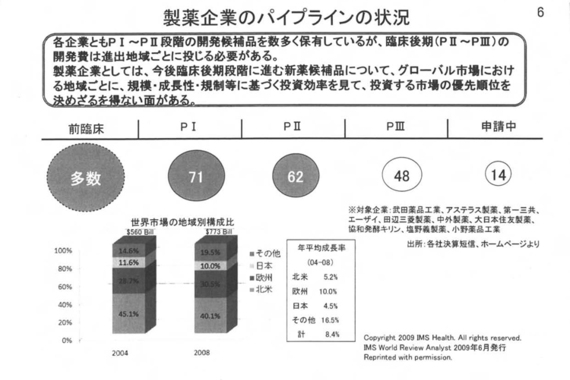 この図は、大手10社のパイプラインの状況を示したもの。前臨床段階のものは情報が開示されていないので臨床段階のものだけを見ると、各社多くの新薬(候補)を保有している。臨床試験はフェーズ1、2、3という3段階のハードルをクリアして、ようやく申請にこぎ着けることができる。
この図は、大手10社のパイプラインの状況を示したもの。前臨床段階のものは情報が開示されていないので臨床段階のものだけを見ると、各社多くの新薬(候補)を保有している。臨床試験はフェーズ1、2、3という3段階のハードルをクリアして、ようやく申請にこぎ着けることができる。
2号(診療)側の先生方には申し上げるまでもないことだが、一般的に後期の臨床試験ほど必要とされる症例数も多く、臨床開発全体の7割ぐらいがフェーズ3に費やされるのが実態。
また、フェーズ2やフェーズ3の後期臨床開発は申請しようとする地域ごとに、日米欧を別々に行う必要があるケースが多くある。国際同時開発が理想ではあるが、現実にはどの地域でどの製品を優先して開発するかについては、市場ごとの投資効率を見て決めざるを得ないという状況がある。
日本は世界の市場の約10%を占めており、国単位で見ると世界第2位の市場であり、決して無視できないが、米国市場と比較すると4分の1以下で、またレギュラトリー面で単一化している欧州市場と比べても3分の1ぐらい。
さらに、(海外戦略で成長する)オリックスに代表される(中国やインドなど)新興国が著しい成長を示している中で、外国大手製薬企業から見た日本市場の優先度は相対的に低下してきていると言わざるを得ない。
外資系企業から見た市場の魅力度や優先度は、市場の規模のみならず治験や承認のスピード、製品上市後の投資回収のスピード等、イノベーションを促進するような仕組みになっているかどうかも重要なファクター。次のページ(ドラッグ・ラグ問題)をお願いいたします。
 日本企業の経営者として、また日本人として、日本国内に早く上市することによって、少しでも患者のQOL改善に貢献したいとの想いはやまやまでございます。しかしながら一方で、株主から合理的、効率的な投資も要請されているところ。
日本企業の経営者として、また日本人として、日本国内に早く上市することによって、少しでも患者のQOL改善に貢献したいとの想いはやまやまでございます。しかしながら一方で、株主から合理的、効率的な投資も要請されているところ。
ここに示したいわゆるドラッグ・ラグの解消には、治験環境の整備や審査の迅速化など政府も既に取り組んでいる。審査の迅速化のためにPMDA(医薬品医療機器総合機構)の240名増員を官民が協力して進めているが、製薬業界としては増員分の人件費全額を審査手数料の倍増という形で受け入れていることも、できればご認識いただければ幸い。
製薬企業が日本における開発着手を早めて、日本においても欧米並みのスピードで新薬を上市し、患者の皆様および医療に携わっている皆様の期待に応えていくためには、これらの政策に加え、今回提案している薬価維持特例は必要であると考える。後ほど、これについても若干付け加えさせていただく。次のページ(未承認薬問題解消への取り組み)をお願いいたします。
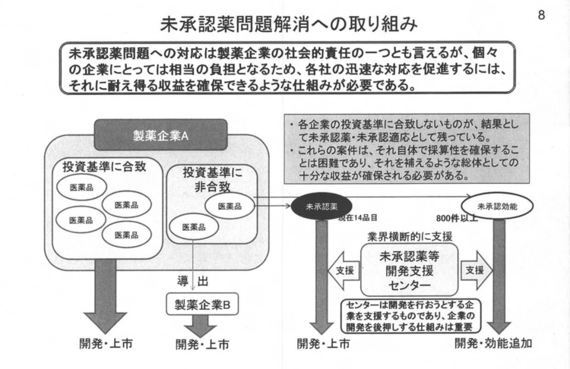 未承認薬問題の解消は、製薬企業の社会的責任の一環として取り組む課題だが、これまでの製薬業界の取り組みは十分ではなかったと批判されてもやむを得ない点があったことは事実と思う。各企業の投資基準に満たないため、採算を取るのが困難なことから、未承認として残っているのが大部分であると判断している。
未承認薬問題の解消は、製薬企業の社会的責任の一環として取り組む課題だが、これまでの製薬業界の取り組みは十分ではなかったと批判されてもやむを得ない点があったことは事実と思う。各企業の投資基準に満たないため、採算を取るのが困難なことから、未承認として残っているのが大部分であると判断している。
この問題を個別企業の判断に委ねていては解決が難しいとの判断から、製薬協メンバー全企業参加の下、(未承認薬等開発)支援センターを設置したところ。この点については、(日医委員から)「業界として当然のことである」とのご指摘もあったように聞いている。
そういう点が「無きにしも非ず」ということは理解するものの、世の中には、当たり前のことが当たり前のように行われていない事例は事欠かず、また企業経営者としても当たり前のことを徹底してやることの難しさを日々、苦労しているのが実態でございます。
私事で恐縮だが、私は山口県の片田舎で、三代続いた開業医の次男。私が小さいころ、父は夜間往診があるたびに、私を車の助手席に乗せて連れて行くのが常だった。子ども心にも、父の状況の意味の大きさとともに大変さも感じた。
このように、一昔前の田舎の開業医にとって、当たり前だった往診も、今は地域医療も厳しくなり、あるいは交通の利便性も改善したことによって、必ずしも当たり前ではないようになっているとも聞いているが......、まあ、私が医者にならなかったのはそのせいでは決してなく、(会場、笑い)勉強が嫌いで成績も芳しくなかったことからである念のために指摘しておきたい。
余談ではあるが、官民対話を通じて、官民協力によるパンデミックワクチン対策にも取り組んでいることを最後に申し添えさせていただく。
 最後に、今回の提案の趣旨は、「新薬と後発品の役割分担を明確にし、公的で貴重な医療財源を合理的・効率的に配分したい」という考えに基づくもの。従って、この制度が実際に採用され、浸透していけば新薬の開発が促進され、ドラッグ・ラグの縮小にもつながり、結果、新薬メーカーはより特許保護期間中の新薬のプロモーションに力を注ぐことになり、結果として、ジェネリックサイドと新薬サイドの棲み分けも促進されると考えている。
最後に、今回の提案の趣旨は、「新薬と後発品の役割分担を明確にし、公的で貴重な医療財源を合理的・効率的に配分したい」という考えに基づくもの。従って、この制度が実際に採用され、浸透していけば新薬の開発が促進され、ドラッグ・ラグの縮小にもつながり、結果、新薬メーカーはより特許保護期間中の新薬のプロモーションに力を注ぐことになり、結果として、ジェネリックサイドと新薬サイドの棲み分けも促進されると考えている。
それは、欧米型に近い市場構造であり、そのことによって少なくとも欧米並みに新薬の上昇を早め、国民の皆様の要請にも応えられると思う。これはタイミングの問題で、「(薬価維持特例の導入が)なぜ今でなければいけないか」という質問があったと聞いているが、私どもとしては、業界のエゴとか、業界のためだけではなく、医療産業、医薬品産業全体にとって進むべき方向であると確信しているし、厚生労働省が出した「(新医薬品)産業ビジョン」にも沿うものと考えている。
従って、できるだけ早く実施していただくことが産業のみならず国益にもかなうと確信しているので、そのことを斟酌賜れば大変幸甚に存じ上げる。以上でございます。
[遠藤久夫部会長(学習院大経済学部教授、中医協会長)]
はい。ありがとうございます。関口会長、何かございますか。
【目次】
P2 → 「海外で稼いだ利益を日本に納税している」 ─ 長谷川氏(日薬連)
P3 → 「日本市場の魅力が非常に落ちてきている」 ─ 関口氏(製薬協)
P4 → 「外資系だけでは薬剤の供給体制に支障をきたすか」 ─ 中川委員(日医)
P5 → 「外資と内資が一体となって投資・生産する時代」 ─ 北村委員(経団連)
P6 → 「医薬品の研究開発は税制などで支援されている」 ─ 小林委員(全国健康保険協会)
P7 → 「試してみる必要性はあるのではないか」 ─ 山本委員(日薬)
P8 → 「効率化のメカニズムが働かないところに大きな懸念」 ─ 藤原委員(日医)
P9 → 「維持特例ということも検討していいのではないか」 ─ 小島委員(連合)
P10 → 「新たな医療費財源が発生する」 ─ 中川委員(日医)
